معتبرسازی داروسازی | ولیدیشن داروسازی
معتبرسازی فرآیند تولید محصولات نهایی در صنعت داروسازی
در صنعت داروسازی، کیفیت و ایمنی محصولات نهایی تنها به مواد اولیه مرغوب یا تجهیزات پیشرفته محدود نمیشود.
آنچه واقعاً تعیینکننده است، کنترل کامل فرآیند تولید و اثبات پایداری آن در تولید محصولی با کیفیت ثابت و ایمن است که به این فرایند معتبرسازی فرآیند (Process Validation) می گویند.
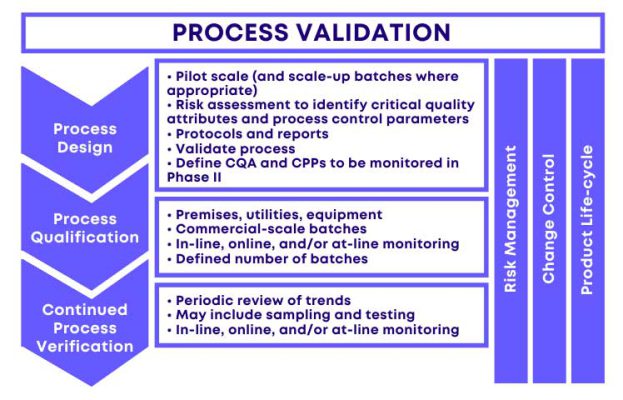
معتبرسازی فرآیند در حقیقت نشان میدهد که یک فرآیند طراحیشده، وقتی تحت شرایط تعریفشده و با پارامترهای مشخص اجرا شود، قادر است بهطور مداوم محصولی مطابق با الزامات کیفی از پیش تعیینشده تولید کند.
سازمانهای نظارتی بینالمللی همچون FDA (Food and Drug Administration، EMA (European Medicines Agency) ، WHO (سازمان جهانی بهداشت) و PIC/S معتبرسازی فرآیند را یکی از پایههای اصلی رعایت GMP (Good Manufacturing Practice) میدانند.
معتبرسازی داروسازی | ولیدیشن داروسازی
بدون اجرای معتبرسازی فرآیند، یک کارخانه داروسازی نمیتواند مجوز تولید و عرضه محصول جدید خود را در بازارهای داخلی یا بینالمللی دریافت کند. بنابراین معتبرسازی نه تنها یک الزام قانونی است، بلکه **ابزاری برای کاهش ریسک، بهبود بهرهوری و حفظ اعتبار برند دارویی** نیز محسوب میشود.

اهداف معتبرسازی داروسازی | ولیدیشن داروسازی
هدف اصلی معتبرسازی فرآیند، ایجاد اطمینان از این موضوع است که هر بار که محصول تولید میشود، کیفیت آن مطابق با استانداردهای تعیینشده باشد. اما در جزئیات میتوان اهداف زیر را برشمرد:
کاهش ریسکهای کیفی و ایمنی: جلوگیری از تولید محصولات غیراستاندارد یا دارای آلودگی.
بهینهسازی فرآیند تولید: شناسایی نقاط ضعف و بهبود کارایی خط تولید.
کاهش هزینههای ناشی از خطا: پیشگیری از دوبارهکاریها، ضایعات یا جمعآوری محصول از بازار.
افزایش اعتماد سازمانهای نظارتی: تسهیل روند بازرسی و دریافت مجوزهای تولید و صادرات.
حفظ سلامت بیماران: تضمین میکند که مصرفکننده نهایی محصولی ایمن و مؤثر دریافت کند.
مسئولیت افراد و دپارتمانها در معتبرسازی
اجرای موفق معتبرسازی فرآیند نیازمند همکاری بینبخشی است. در یک سازمان داروسازی، مسئولیتها به شرح زیر تقسیم میشود:
| مدیریت ارشد: تصویب سیاستها، اختصاص منابع مالی و انسانی و حمایت از اجرای برنامههای معتبرسازی. |
| واحد تضمین کیفیت (QA): طراحی پروتکلهای معتبرسازی، نظارت بر اجرا، مستندسازی و تأیید نهایی. |
| واحد کنترل کیفیت (QC) : انجام تستهای آزمایشگاهی، تحلیل دادهها و گزارشدهی نتایج. |
| واحد تولید : اجرای فرآیندهای تولیدی تحت شرایط تعریفشده و ثبت کلیه دادهها. |
| واحد تحقیق و توسعه (R\&D) : طراحی اولیه فرآیند، انجام مطالعات آزمایشی و انتقال دانش فنی به تولید. |
| واحد مهندسی و نگهداری: تضمین عملکرد صحیح تجهیزات، تأسیسات و سیستمهای پشتیبان. |
الزامات قانونی و مقررات بینالمللی
معتبرسازی فرآیند تولید دارو بخشی جدایی ناپذیر از الزامات قانونی است. برخی از مهمترین مرجعها عبارتند از:
FDA – 21 CFR Part 211: الزام به اعتبارسنجی فرآیندها و کنترل تغییرات.
EMA – Annex 15: راهنمای معتبرسازی و واجد شرایط بودن تجهیزات و سیستمها.
WHO Technical Report Series: تأکید بر نقش معتبرسازی در تضمین کیفیت دارو.
PIC/S Guidelines: ایجاد هماهنگی میان الزامات GMP در کشورهای مختلف.
این مقررات شرکتها را ملزم میکند که فرآیندهای تولید دارو قابل پیشبینی، قابل تکرار و مستند باشند.
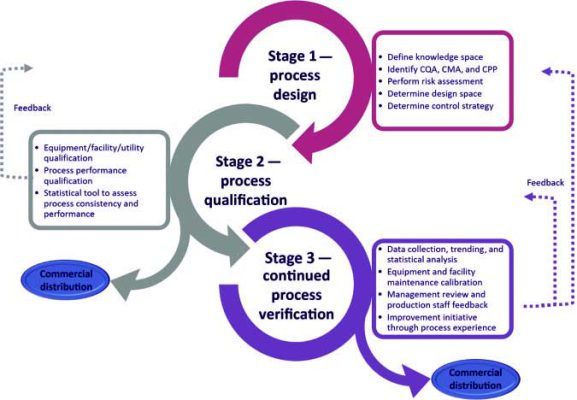
مراحل معتبرسازی: DQ، IQ، OQ و PQ
معتبرسازی فرآیند بهطور مستقیم با معتبرسازی تجهیزات و سیستمها مرتبط است و چهار مرحله اصلی دارد:
- Design Qualification (DQ) – احراز کیفیت طراحی: اطمینان از اینکه طراحی فرآیند و تجهیزات مطابق با الزامات GMP و URS است.
- Installation Qualification (IQ) – احراز کیفیت نصب: بررسی و مستندسازی نصب صحیح تجهیزات طبق مشخصات سازنده.
- Operational Qualification (OQ) – احراز کیفیت عملیاتی: آزمون تجهیزات در شرایط عملیاتی مختلف برای اثبات عملکرد صحیح.
- Performance Qualification (PQ) – احراز کیفیت عملکردی: اطمینان از اینکه تجهیزات و فرآیندها در شرایط واقعی تولید، محصولی با کیفیت ثابت تولید میکنند.
هیچ معتبرسازی بدون مستندسازی ارزش قانونی و علمی ندارد.
مستندات باید شامل موارد زیر باشد:
| پروتکلهای معتبرسازی (Validation Protocols) |
| گزارشهای اجرای تستها |
| نتایج آزمایشهای QC |
| تحلیل دادهها و تصمیمگیریها |
| گزارش نهایی معتبرسازی (Validation Report) |
بر اساس اصول GMP در کارخانه : “If it isn’t documented, it didn’t happen.” اگر کاری مستند نشود انجام نشده است.
|
گواهی ایزو چیست؟ راهنمای کامل انواع گواهینامه ISO برای کسبوکارها |
تغییرات و کنترل آنها (Change Control)
فرآیند تولید دارو ممکن است به دلایل مختلفی دستخوش تغییر شود:
تغییر تأمینکننده مواد اولیه، جابجایی تجهیزات، تغییر فرمولاسیون یا ارتقاء فناوری. در این شرایط، کنترل تغییرات الزامی است
هر تغییر باید توسط QA بررسی شود و در صورت تأثیر بر کیفیت محصول، معتبرسازی مجدد (Revalidation) انجام گیرد.
برنامهریزی تستهای کنترل کیفی و تحلیل دادهها
در معتبرسازی فرآیند، انجام تستهای QC ضروری است.
این تستها شامل بررسی ویژگیهای فیزیکوشیمیایی، میکروبی و عملکردی محصول هستند.
دادههای حاصل باید با استفاده از روشهای آماری مانند ANOVA، Capability Analysis و Control Chartsتحلیل شوند تا اطمینان حاصل شود که فرآیند پایدار و تحت کنترل است.
انواع معتبرسازی فرآیند
| (Traditional Process Validation): معتبرسازی سنتی |
| Prospective Validation: قبل از تولید انبوه، بر اساس مطالعات آزمایشی انجام میشود. |
| Concurrent Validation: همزمان با تولید واقعی انجام میشود. |
| Retrospective Validation: بر اساس دادههای تاریخی تولید انجام میشود. |
| صحهگذاری پیوسته فرآیند (Continuous Process Verification – CPV): رویکردی جدید که در آن فرآیند بهطور مداوم تحت نظارت دادهمحور قرار دارد. این روش مورد تأکید FDA و ICH Q8-Q10 است. |
| رویکرد ترکیبی (Hybrid Approach): ترکیبی از روشهای سنتی و CPV برای افزایش دقت و کاهش ریسک. |
| Revalidation (معتبرسازی مجدد): هرگاه تغییر مهمی در فرآیند رخ دهد یا نتایج قبلی مشکوک باشند، معتبرسازی مجدد الزامی است. |
| بازنگریهای دورهای (Periodic Review) : حتی پس از تکمیل معتبرسازی، فرآیند باید بهطور دورهای مورد بازنگری قرار گیرد. این بازنگری شامل بررسی دادههای تولیدی، کیفیت محصول، تغییرات تجهیزات و الزامات جدید قانونی است. بازنگری دورهای تضمین میکند که فرآیند همواره در شرایط مطلوب باقی بماند. |
اهمیت آموزش و فرهنگسازی
یکی از چالشهای مهم در معتبرسازی، عدم آگاهی یا کمبود مهارت کارکنان است.
آموزش مستمر پرسنل تولید، QC، QA و مهندسی باعث میشود که الزامات معتبرسازی بهصورت یک فرهنگ سازمانی نهادینه شود.
معتبرسازی فرآیند تولید، یکی از ارکان اصلی تضمین کیفیت در صنعت داروسازی است. این فرآیند نه تنها یک الزام قانونی برای اخذ مجوزهای بینالمللی به شمار میآید، بلکه بهعنوان ابزاری برای کاهش ریسکهای تولید، افزایش بهرهوری و حفظ سلامت بیماران اهمیت حیاتی دارد.
شرکتهایی که معتبرسازی فرآیند را بهصورت علمی، مستند و مطابق با استانداردهای بینالمللی اجرا کنند، قادر خواهند بود در بازارهای جهانی رقابت کنند و اعتماد بیماران و سازمانهای نظارتی را جلب نمایند.
Process validation is defined as the collection and evaluation of data throughout the production process and life cycle that establishes scientific evidence that a process is capable of consistently delivering quality products. It involves creating documented evidence that the entire process—from raw materials to the end product—operates within controlled limits and meets all quality standards.
This validation process is essential in ensuring patient safety and regulatory compliance, especially given the complex nature of pharmaceutical manufacturing processes. A validated process ensures that every drug product maintains consistent product quality and efficacy throughout commercial production. Maintaining consistent process control across the entire life cycle of a product is a fundamental expectation in the pharmaceutical process validation framework.





